
时间:2025-05-05 点击数:
近日,我院分子表观遗传学教育部重点实验室刘罡研究员课题组与化学学院江秀梅副教授合作,在氧化锌纳米颗粒的毒理学机制研究中取得重要进展。该研究发现纳米氧化锌在被巨噬细胞所吞噬后所降解出的锌离子可占据铁硫蛋白上负责结合铁硫簇的半胱氨酸残基,从而阻碍铁硫蛋白组装,引发巨噬细胞代谢重编程,促进巨噬细胞极化,进而导致巨噬细胞吞噬红细胞增加以及巨噬细胞铁外排减少。体内实验表明,巨噬细胞铁外排减少导致了小鼠脾脏铁回收障碍,从而造成小鼠出现贫血症状(图1)。相关成果以“ZnO Nanoparticle Exposure Disrupted Iron−Sulfur Protein Functions to Increase Macrophage Erythrophagocytosis and Disturb Systemic Iron Recycling”为题,在材料学领域顶级期刊ACS Nano上发表。
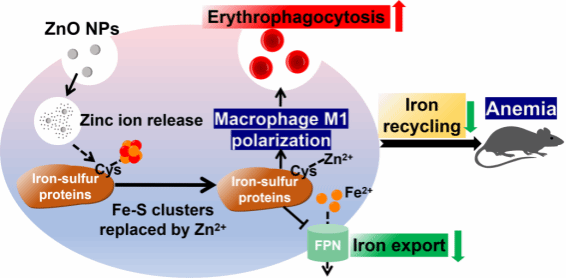
图1. 纳米氧化锌暴露阻碍机体铁回收的分子机制示意图
纳米科技给人类带来希望的同时,也带来了前所未有的挑战。越来越多的纳米材料进入到人们的生活当中,其安全性问题也受到了广泛的关注。纳米尺寸的氧化锌因其独特的理化性质和光学特性,在食品工业、化妆品、涂料、纺织品和生物医学研究领域中被广泛应用。无论是工业生产中还是日常生活中使用纳米氧化锌产品,都会不可避免有一定程度的纳米氧化锌暴露,进而产生机体毒性。因此,深入挖掘纳米氧化锌产生机体毒性的分子机制将有助于推动纳米氧化锌产品研制方法的改进和相关政策的制定。在纳米氧化锌所造成的众多机体毒性效应中,贫血是最为常见的一种。然而截至目前,纳米氧化锌引发贫血这一现象背后的细胞和分子生物学机制尚不清楚。本研究描述了一类全新的纳米材料-生物分子相互作用机制,以独特视角阐明了纳米氧化锌的机体血液毒性机制,从而为纳米氧化锌的安全规范使用和相关政策制定提供理论依据。
化学学院江秀梅副教授、我院硕士研究生任玉洁为本文的共同第一作者,我院刘罡研究员为本文的通讯作者。本研究受国家自然科学基金青年项目(32401164)、吉林省科技厅医药健康产业处重点研发项目(20240305100YY)、中央高校基本科研业务费(2412023QD009, 2412023QD022)以及东北师范大学科研启动资金等基金项目支持。
文章链接:https://pubs.acs.org/doi/10.1021/acsnano.5c01592
初审:刘 罡
复审:王俊锋
终审:王海涛